
 | Biologie |
Die Untersuchung mit Hilfe von Neutronen bietet gegenüber Röntgenuntersuchungen oder Elektronenmikroskopie einige Vorteile, z.B.:
Die Analyse mit Neutronen erfolgt zerstörungsfrei...
... wodurch auch Experimente an lebendem Material möglich sind. Dies ist auch besonders wichtig bei der Beobachtung biologischer Prozesse, da die Funktion der Biomoleküle trotz des Neutronenbeschusses weiterhin aufrecht erhalten werden kann.
Für derartige Versuche mit zeitlicher Auflösung wäre die ESS aufgrund ihrer Pulsung und der hohen Leistung besonders gut geeignet. Näheres
Neutronen dringen tief in die Proben ein
Dies ermöglicht Einblicke ins Innere von Proben. Aber auch Oberflächenuntersuchungen sind mit speziellen Verfahren möglich.
Bewegungsnachweise von Molekülen sind möglich
Man kann mit Hilfe der Flugzeitspektroskopie Bewegung nachweisen.
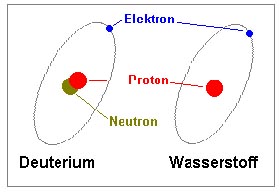
Neutronen streuen unterschiedlich je nach Isotop
So ist es möglich, zwischen Wasserstoff und Deuterium zu unterscheiden, was eine Markierung von Molekülen oder Molekülteilen ermöglicht oder auch durch Kontrastanpassung die Ausblendung dieser ermöglicht. Näheres
Außerdem ist die Neutronenstreuung neben der Kernresonanzspektroskopie die einzige Methode, mit der man Wasserstoffatome im Beisein von Kohlenstoff, dem Hauptbestandteil lebender Materie, direkt sichtbar machen kann.
Zusammenfassend bieten Neutronen in manchen Fällen eine ideale Ergänzung zu herkömmlichen Untersuchungsmethoden.
Um einen Überblick über den Nutzen, den die aufwendige Arbeit mit den Neutronen mit sich bringt, zu geben, sind im Folgenden einige Anwendungsbeispiele aufgelistet.
Durchgeführt wurden diese Versuche an der Neutronenquelle in Grenoble. Näheres hierzu beim ILL.
Auf welche Art und Weise unser Körper die unterschiedlichsten Nährstoffe aufnimmt, ist bei weitem noch nicht so weit erforscht, wie man zuerst glauben mag und bietet nach wie vor ein breites Feld für wissenschaftliche Betätigung.
Angesichts der heutigen Essgewohnheiten ist es lohnenswert, die Verdauung von Fett (genauer: von Triglyceriden, welche unter den in Lebensmitteln enthaltenen Fetten 95% ausmachen) zu untersuchen, um u.a. neue Medikamente gegen Fettleibigkeit zu entwickeln.
Da Fette aufgrund ihrer unpolaren Kohlenwasserstoffketten nicht wasserlöslich sind, bilden sich (wie auf der Suppe) Tröpfchen. Die Frage ist nun: Wie setzen die Verdauungsenzyme an diesen Tropfen an? Das für die Zersetzung von Fetten zuständige Enzym ist die von der Bauchspeicheldrüse produzierte Lipase. Diese ist jedoch aufgrund ihres Aufbaus nicht allein fähig, diesen Prozess durchzuführen. Unterstützt wird sie dabei zum einen von einem speziellen Gallensalz, das die Bildung von Micellen bewirkt und der Colipase, welche sich mit der Lipase zu einem Komplex verbindet.
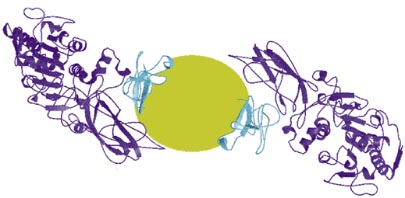 Mit HIlfe der Neutronenstreuung und der Kontrastvariation konnte die genaue Lage der Lipase und Colipase bezüglich der Micelle ermittelt werden:
Bei einem D2O-Gehalt von 10% (und den restlichen 90% H2O) im umgebenden Medium hatte man die Micelle ausgeblendet und konnte somit feststellen, dass an einer Micelle jeweils zwei Colipasen angeheftet waren. An diesen Colipasen wiederum war jeweils eine Lipase angelagert.
Mit HIlfe der Neutronenstreuung und der Kontrastvariation konnte die genaue Lage der Lipase und Colipase bezüglich der Micelle ermittelt werden:
Bei einem D2O-Gehalt von 10% (und den restlichen 90% H2O) im umgebenden Medium hatte man die Micelle ausgeblendet und konnte somit feststellen, dass an einer Micelle jeweils zwei Colipasen angeheftet waren. An diesen Colipasen wiederum war jeweils eine Lipase angelagert.
 Dass manche Enzyme hohe Temperaturen vertragen, ist spätestens seit der Entdeckung von Bakterien in heißen Quellen bekannt. Diese Bakterien benutzen spezielle Enzyme, u.a. die sogenannte Taq-Polymerase.
Dass manche Enzyme hohe Temperaturen vertragen, ist spätestens seit der Entdeckung von Bakterien in heißen Quellen bekannt. Diese Bakterien benutzen spezielle Enzyme, u.a. die sogenannte Taq-Polymerase.
Da wir Menschen, bzw. unsere Enzyme, jenseits der 70°C nun wirklich gar nichts mehr zu lachen haben, liegt die Vermutung nahe, dass Taq-Polymerase & Co besondere chemische und physikalische Eigenschaften entwickelt haben um die Temperaturtoleranz zu erhöhen.
Eine gängige Theorie war es, dass hitzebeständige Proteine eine besonders starre Struktur, d.h. möglichst viele Bindungen zwischen den Aminosäuren (Siehe Proteine Struktur) aufwiesen und somit durch starken Zusammenhalt die Zerstörung der Polypeptidketten bei steigender Energie verhindert würde. Zudem schienen Ergebnisse anderer Analysetechniken diese These zu untermauern.
Da das Interesse in der Industrie an wärmeverträglichen Proteinen besonders hoch ist, beschäftigte sich ein Forscherteam der Technischen Universität Darmstadt in Zusammenarbeit mit dem ILL ausführlich mit einem solchen Enzym und seinem "normaltemperierten" Äquivalent. Bei diesem Versuchsobjekt handelte es sich um die a-Amylase, ein Pflanzenenzym, welches Stärke im keimenden Samen verarbeitet.
Der Versuch:
An einzelnen Stellen in den Enzymen wurden zuerst Deuterium-Marker angebracht, indem dort Wasserstoffatome durch Deuterium ersetzt wurden. Dabei stellte sich heraus, dass die Polypeptidketten des wärmeliebenden Enzyms sich viel flexibler bewegten. Die Erklärung hierfür liegt in der Thermodynamik. Vereinfacht ausgedrückt: Die freiere Beweglichkeit der Molekülketten verhindert ein Aufreissen von Bindungen bis zu einem bestimmten Energieniveau. Dies liegt daran, dass die Energie hierbei noch in Bewegung umgesetzt werden kann, soweit die Bindung dies erlaubt. Dieser kritische Punkt ist dementsprechend bei kleineren Bewegungsräumen, also bei besonders stark fixierten und kompakten Proteinen, schneller erreicht.
Liposomen als Genfähren
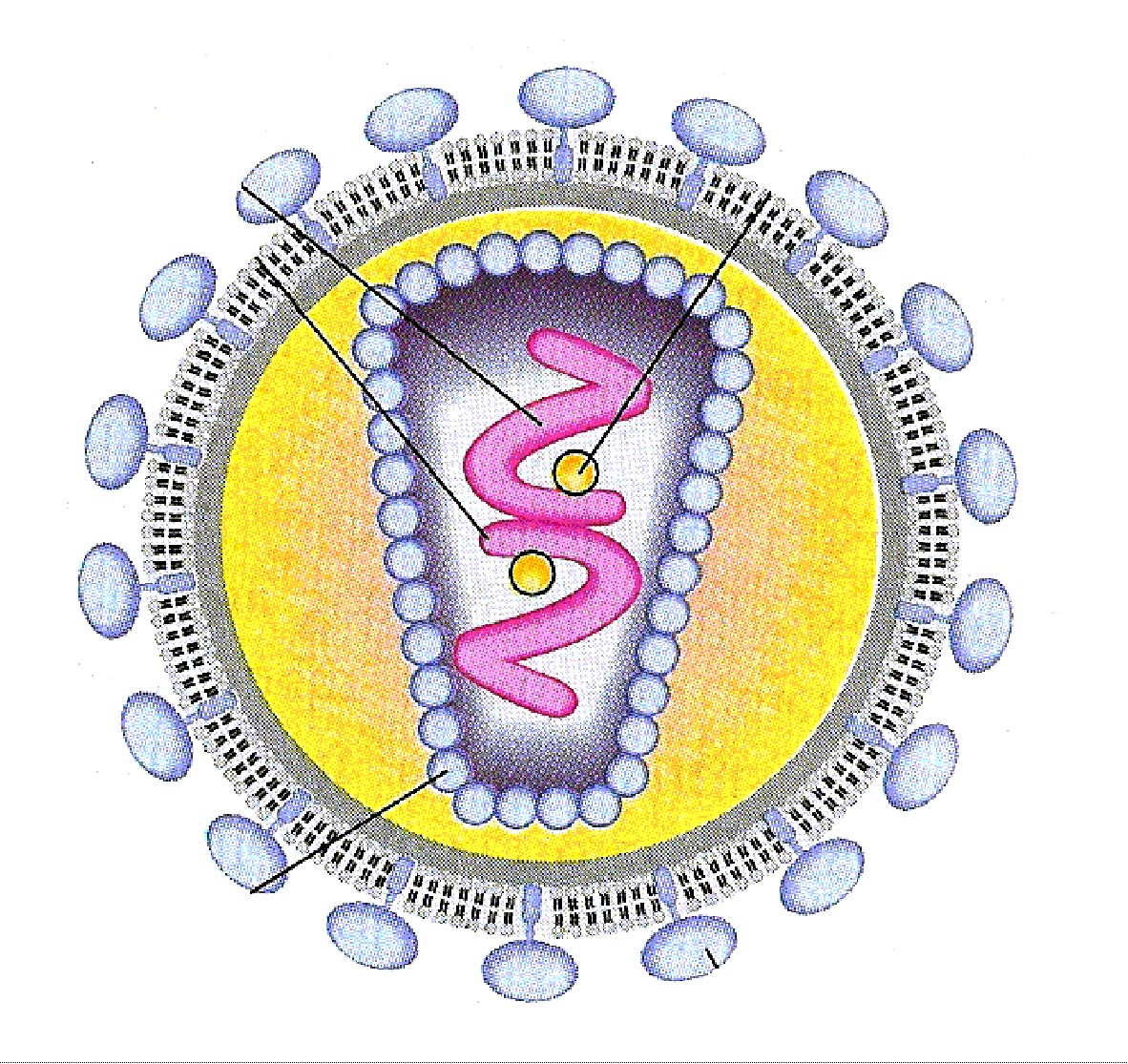 Ziel der Gentherapie ist es, durch Integration von Genen gezielt die Bildung von spezifischen Proteinen zu bewirken. Man hofft auf diese Weise Mangelerscheinungen ausgleichen zu können oder Infektionskrankheiten zu bekämpfen, z.B. durch die enzymatische Zerlegung der Erreger.
Hierbei stellen sich momentan noch zahlreiche Probleme. Eines davon:
Ziel der Gentherapie ist es, durch Integration von Genen gezielt die Bildung von spezifischen Proteinen zu bewirken. Man hofft auf diese Weise Mangelerscheinungen ausgleichen zu können oder Infektionskrankheiten zu bekämpfen, z.B. durch die enzymatische Zerlegung der Erreger.
Hierbei stellen sich momentan noch zahlreiche Probleme. Eines davon:
Wie kann man die Strukturgene für ein bestimmtes Protein unbeschädigt in die Zielzellen einbringen?
Ein Forscherteam vom King's College London und der ILL untersucht zu diesem Zweck Liposomen (Was sind Liposomen?). Wenn man Liposomen als Genfähren einsetzen will, so muss man wissen, wie Liposomen mit ihrem Inhalt interagieren. So platzen bestimmte Liposomen auf, wenn sie mit Genen gefüllt eine Zellmembran berühren, und die Gene gehen verloren. Dementsprechend ist es das Ziel, die ideale Kombination von Liposomen und DNS zu finden, um die Übertragung zu gewährleisten. Zu diesem Zwecke bedient man sich der Kleinwinkelstreuung (einer Sonderform der Streuung), wobei man das Verhalten der gefüllten Liposomen bei der Annäherung an eine künstliche Membran untersucht. Außerdem wird zusätzlich (ebenfalls mit Neutronen) der Liposom-Gen-Komplex gesondert in wässriger Umgebung analysiert. Auch dies soll Rückschlüsse auf die Tauglichkeit der Liposomensorten zum Gentransfer geben.
 Einige Pflanzen und Tiere haben sich Wüstenregionen soweit angepasst, dass sie selbst Phasen absoluten Wasserentzugs bedingt durch Hitze und Trockenheit überleben. Wie ist dies möglich, da Proteine ohne wässrige Umgebung nicht überleben?
Einige Pflanzen und Tiere haben sich Wüstenregionen soweit angepasst, dass sie selbst Phasen absoluten Wasserentzugs bedingt durch Hitze und Trockenheit überleben. Wie ist dies möglich, da Proteine ohne wässrige Umgebung nicht überleben?
Man stellte bei diesen Organismen eine stark erhöhte Konzentration eines bestimmten Zuckers, der Trehalose, im Zellplasma fest. Trockneten die Zellen aus, bildeten sich Kapseln um die Proteine. Um deren Auswirkungen zu erforschen, untersuchte man von Trehalose eingehüllte Myoglobin-Proteine mit Hilfe von Neutronen.
Das Ergebnis: Innerhalb der Kapseln war das Protein erstarrt und behielt diesen Zustand auch bei hohen Temperaturen bei.
Außerdem hatte man (ohne Neutronen) festgestellt, dass das Protein in diesem Zustand keinen Sauerstoff aufnehmen konnte.
Betrachtet man die Molekularbewegungen eines Proteins, so stellt man fest, dass es insgesamt nur drei Phasen gibt, welche in Abhängigkeit von der Temperatur und dem umgebenden Medium eingenommen werden können:
 Um noch einmal auf die einleitend bereits genannte Thematik der Deuterierung zurückzukommen, ist es zunächst nötig den Begriff der Kontrastvariation näher zu erläutern.
Um noch einmal auf die einleitend bereits genannte Thematik der Deuterierung zurückzukommen, ist es zunächst nötig den Begriff der Kontrastvariation näher zu erläutern.
Stellen Sie sich vor, Ihnen ist ein Diamant in einen Haufen Glasscherben gefallen.
Die Materialien Diamant und Glas können zwar für das Laienauge identisch aussehen, aber sie besitzen unterschiedliche Lichtbrechungseigenschaften. Passt man nun den Brechungsindex eines Mediums (beispielsweise Wasser durch Zugabe von Salzen) an den der Glassteine an, wird man feststellen, dass diese im Medium unsichtbar werden. Die Konturen der Diamanten bleiben jedoch weiterhin erkenntlich.
Genauso verfährt man auch bei der Kontrastanpassung der Präparate. Hierbei wird das umgebende Medium so deuteriert (Wasserstoff wird durch das schwerere Isotop Deuterium ersetzt), dass die auszublendenden Teile die Neutronen in gleicher Intensität wie das Medium streuen. Dieses Einheitssignal von Medium und "unsichtbarer" Materie lässt sich nun ausfiltern und man kann sich auf das eigentliche Ziel der Untersuchung konzentrieren.
Ein besonders interessantes Anwendungsbeispiel, bei welchem vorrangig mit eben dieser Methode gearbeitet wurde, ist die Lokalisation einzelner Proteinbestandteile in der kleinen prokaryotischen Ribosomenuntereinheit. (Ribosomen sind für die Proteinherstellung verantwortliche Zell-Organellen. Ohne sie wäre eine Zelle nicht lebensfähig). So konnte man also 21 Proteine identifizieren und ihre Lage untereinander bestimmen. Dies gilt auch für die Lagebeziehung zwischen RNA (Ribonucleinacid) und Protein (vgl. Translation).
Bei diesem Projekt machten sich die Wissenschaftler zwei Eigenschaften der Neutronenbeugung zunutze:
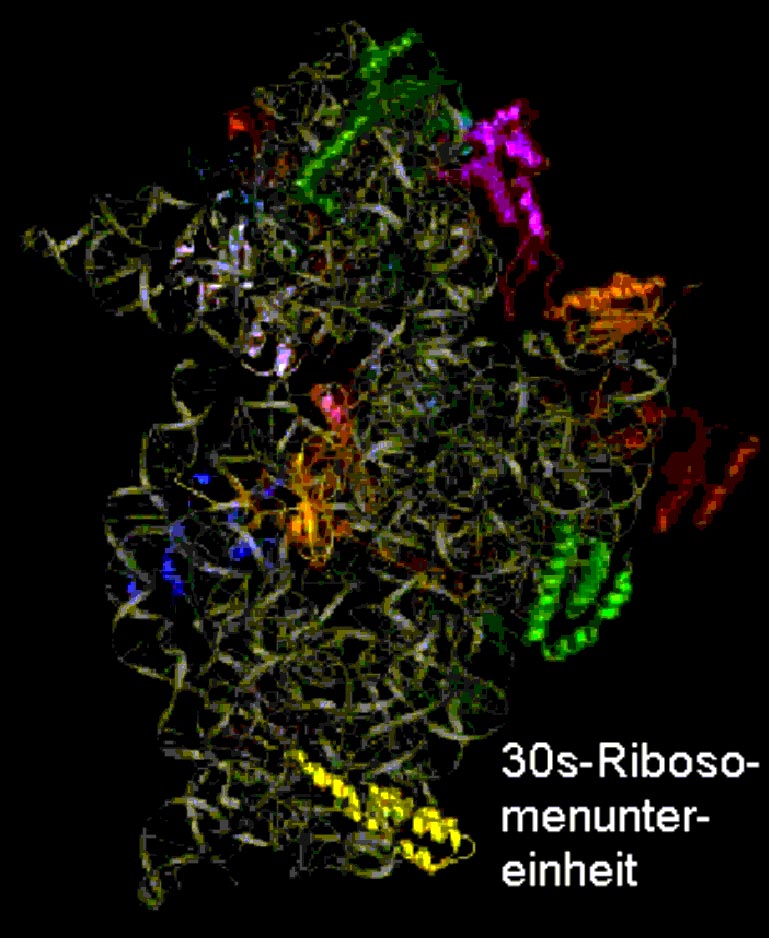 Es war gelungen, bestimmte Bakterien in einem D2O (der im H2O enthaltene Wasserstoff wurde durch sein Isotop Deuterium ersetzt) Medium heranzuzüchten. Diese können die einzelnen Proteinen, aus denen sich die Ribosomenuntereinheit zusammensetzt, synthetisieren (vgl. Quartärstruktur).
Ließ man nun jeweils 2 dieser deuterierten Proteine in die 30s-Untereinheit einbauen, konnte man in mehreren Versuchsreihen die genauen Lageverhältnisse aller Proteine innerhalb der Ribosomeneinheit rekonstruieren.
Es war gelungen, bestimmte Bakterien in einem D2O (der im H2O enthaltene Wasserstoff wurde durch sein Isotop Deuterium ersetzt) Medium heranzuzüchten. Diese können die einzelnen Proteinen, aus denen sich die Ribosomenuntereinheit zusammensetzt, synthetisieren (vgl. Quartärstruktur).
Ließ man nun jeweils 2 dieser deuterierten Proteine in die 30s-Untereinheit einbauen, konnte man in mehreren Versuchsreihen die genauen Lageverhältnisse aller Proteine innerhalb der Ribosomeneinheit rekonstruieren.
Die virtuelle Zelle ist noch ein futuristisches Ziel der Wissenschaft. Sie soll ein interaktives Spiegelbild natürlicher Zellfunktionen sein und auch computerkalkulierte Experimente ermöglichen. Durch die Nutzung verschiedener Untersuchungsmethoden und Datenbanken rückt man diesem Ziel immer näher. Die Resultate, welche durch Neutronenstreuung erzielt werden können, ergänzen jene, welche durch die anderen zur Verfügung stehenden Analysetechniken ( small angle X-ray scattering / Elektronenmikroskopie / Ultrazentrifugation) erreicht werden können.
Simulierte Experimente würden beispielsweise eine weitreichende Reduzierung des zur Medikamentenentwicklung benötigten Aufwands bewirken. Hierzu benötigt man ausführliche Informationen über die genauen intrazellulären Abläufe um eine möglichst realistische Simulation zu erstellen, wobei man sich von der ESS weniger auf atomarer als auf der funktionellen Ebene (Bewegungsabläufe, Moleküldynamik) Erkenntnisse erhofft.